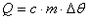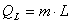Termometria:
- Temperatura:
Chamamos de Termologia a parte da física que estuda os fenômenos relativos ao calor, aquecimento, resfriamento, mudanças de estado físico, mudanças de temperatura, etc.
Temperatura é a grandeza que caracteriza o estado térmico de um corpo ou sistema.
Fisicamente o conceito dado a quente e frio é um pouco diferente do que costumamos usar no nosso cotidiano. Podemos definir como quente um corpo que tem suas moléculas agitando-se muito, ou seja, com alta energia cinética. Analogamente, um corpo frio, é aquele que tem baixa agitação das suas moléculas.
Ao aumentar a temperatura de um corpo ou sistema pode-se dizer que está se aumentando o estado de agitação de suas moléculas.
Ao tirarmos uma garrafa de água mineral da geladeira ou ao retirar um bolo de um forno, percebemos que após algum tempo, ambas tendem a chegar à temperatura do ambiente. Ou seja, a água "esquenta" e o bolo "esfria". Quando dois corpos ou sistemas atingem o mesma temperatura, dizemos que estes corpos ou sistemas estão em equilíbrio térmico.
Chamamos de Termologia a parte da física que estuda os fenômenos relativos ao calor, aquecimento, resfriamento, mudanças de estado físico, mudanças de temperatura, etc.
Temperatura é a grandeza que caracteriza o estado térmico de um corpo ou sistema.
Fisicamente o conceito dado a quente e frio é um pouco diferente do que costumamos usar no nosso cotidiano. Podemos definir como quente um corpo que tem suas moléculas agitando-se muito, ou seja, com alta energia cinética. Analogamente, um corpo frio, é aquele que tem baixa agitação das suas moléculas.
Ao aumentar a temperatura de um corpo ou sistema pode-se dizer que está se aumentando o estado de agitação de suas moléculas.
Ao tirarmos uma garrafa de água mineral da geladeira ou ao retirar um bolo de um forno, percebemos que após algum tempo, ambas tendem a chegar à temperatura do ambiente. Ou seja, a água "esquenta" e o bolo "esfria". Quando dois corpos ou sistemas atingem o mesma temperatura, dizemos que estes corpos ou sistemas estão em equilíbrio térmico.
Escalas Termométricas:
Para que seja possível medir a temperatura de um corpo, foi desenvolvido um aparelho chamado termômetro.
O termômetro mais comum é o de mercúrio, que consiste em um vidro graduado com um bulbo de paredes finas que é ligado a um tubo muito fino, chamado tubo capilar.
Quando a temperatura do termômetro aumenta, as moléculas de mercúrio aumentam sua agitação fazendo com que este se dilate, preenchendo o tubo capilar. Para cada altura atingida pelo mercúrio está associada uma temperatura.
A escala de cada termômetro corresponde a este valor de altura atingida.
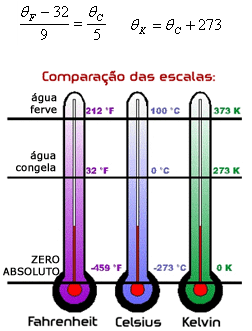
0°C=32°F
100°C=212°F
Por convenção, não se usa "grau" para esta escala, ou seja 0K, lê-se zero kelvin e não zero grau kelvin. Em comparação com a escala Celsius:
-273°C=0K
0°C=273K
100°C=373
- Conversão entre escalas:
Para que seja possível expressar temperaturas dadas em uma certa escala para outra qualquer deve-se estabelecer uma convenção geométrica de semelhança. Por exemplo, convertendo uma temperatura qualquer dada em escala Fahrenheit para escala Celsius ou para a escala Kelvin.
Segue abaixo a comparação das escalas termométricas e as fórmulas para a conversão entre escalas.
O termômetro mais comum é o de mercúrio, que consiste em um vidro graduado com um bulbo de paredes finas que é ligado a um tubo muito fino, chamado tubo capilar.
Quando a temperatura do termômetro aumenta, as moléculas de mercúrio aumentam sua agitação fazendo com que este se dilate, preenchendo o tubo capilar. Para cada altura atingida pelo mercúrio está associada uma temperatura.
A escala de cada termômetro corresponde a este valor de altura atingida.
- Escala Celsius:
- Escala Fahrenheit:
0°C=32°F
100°C=212°F
- Escala Kelvin:
Por convenção, não se usa "grau" para esta escala, ou seja 0K, lê-se zero kelvin e não zero grau kelvin. Em comparação com a escala Celsius:
-273°C=0K
0°C=273K
100°C=373
- Conversão entre escalas:
Para que seja possível expressar temperaturas dadas em uma certa escala para outra qualquer deve-se estabelecer uma convenção geométrica de semelhança. Por exemplo, convertendo uma temperatura qualquer dada em escala Fahrenheit para escala Celsius ou para a escala Kelvin.
Segue abaixo a comparação das escalas termométricas e as fórmulas para a conversão entre escalas.
Calorimetria:
- Calor:
Quando colocamos dois corpos com temperaturas diferentes em contato, podemos observar que a temperatura do corpo "mais quente" diminui, e a do corpo "mais frio" aumenta, até o momento em que ambos os corpos apresentem temperatura igual. Esta reação é causada pela passagem de energia térmica do corpo "mais quente" para o corpo "mais frio", a transferência de energia é o que chamamos calor.
Calor é a transferência de energia térmica entre corpos com temperaturas diferentes.
A unidade mais utilizada para o calor é caloria (cal), embora sua unidade no SI seja o joule (J). Uma caloria equivale a quantidade de calor necessária para aumentar a temperatura de um grama de água pura, sob pressão normal, de 14,5°C para 15,5°C.
A relação entre a caloria e o joule é dada por:
1 cal = 4,186J
Como 1 caloria é uma unidade pequena, utilizamos muito o seu múltiplo, a quilocaloria.
1 kcal = 10³cal
- Calor Sensível:
É denominado calor sensível, a quantidade de calor que tem como efeito apenas a alteração da temperatura de um corpo.
Este fenômeno é regido pela lei física conhecida como Equação Fundamental da Calorimetria, que diz que a quantidade de calor sensível (Q) é igual ao produto de sua massa, da variação da temperatura e de uma constante de proporcionalidade dependente da natureza de cada corpo denominada calor específico.
Assim:
Quando colocamos dois corpos com temperaturas diferentes em contato, podemos observar que a temperatura do corpo "mais quente" diminui, e a do corpo "mais frio" aumenta, até o momento em que ambos os corpos apresentem temperatura igual. Esta reação é causada pela passagem de energia térmica do corpo "mais quente" para o corpo "mais frio", a transferência de energia é o que chamamos calor.
Calor é a transferência de energia térmica entre corpos com temperaturas diferentes.
A unidade mais utilizada para o calor é caloria (cal), embora sua unidade no SI seja o joule (J). Uma caloria equivale a quantidade de calor necessária para aumentar a temperatura de um grama de água pura, sob pressão normal, de 14,5°C para 15,5°C.
A relação entre a caloria e o joule é dada por:
1 cal = 4,186J
Como 1 caloria é uma unidade pequena, utilizamos muito o seu múltiplo, a quilocaloria.
1 kcal = 10³cal
- Calor Sensível:
É denominado calor sensível, a quantidade de calor que tem como efeito apenas a alteração da temperatura de um corpo.
Este fenômeno é regido pela lei física conhecida como Equação Fundamental da Calorimetria, que diz que a quantidade de calor sensível (Q) é igual ao produto de sua massa, da variação da temperatura e de uma constante de proporcionalidade dependente da natureza de cada corpo denominada calor específico.
Assim:
Onde:
Q = quantidade de calor sensível (cal ou J).
c = calor específico da substância que constitui o corpo (cal/g°C ou J/kg°C).
m = massa do corpo (g ou kg).
Δθ = variação de temperatura (°C).
Quando:
- Calor Latente:
Nem toda a troca de calor existente na natureza se detém a modificar a temperatura dos corpos. Em alguns casos há mudança de estado físico destes corpos. Neste caso, chamamos a quantidade de calor calculada de calor latente.
A quantidade de calor latente (Q) é igual ao produto da massa do corpo (m) e de uma constante de proporcionalidade (L).
Assim:
Q = quantidade de calor sensível (cal ou J).
c = calor específico da substância que constitui o corpo (cal/g°C ou J/kg°C).
m = massa do corpo (g ou kg).
Δθ = variação de temperatura (°C).
Quando:
- Q>0: o corpo ganha calor.
- Q<0: o corpo perde calor.
- Calor Latente:
Nem toda a troca de calor existente na natureza se detém a modificar a temperatura dos corpos. Em alguns casos há mudança de estado físico destes corpos. Neste caso, chamamos a quantidade de calor calculada de calor latente.
A quantidade de calor latente (Q) é igual ao produto da massa do corpo (m) e de uma constante de proporcionalidade (L).
Assim:
A constante de proporcionalidade é chamada calor latente de mudança de fase e se refere a quantidade de calor que 1g da substância calculada necessita para mudar de uma fase para outra.
Além de depender da natureza da substância, este valor numérico depende de cada mudança de estado físico. Por exemplo, para a água:
- Capacidade Térmica:
É a quantidade de calor que um corpo necessita receber ou ceder para que sua temperatura varie uma unidade. Então, pode-se expressar esta relação como mostra a figura abaixo:
Sua unidade usual é cal/°C.
A capacidade térmica de 1g de água é de 1cal/°C já que seu calor específico é 1cal/g.°C.
Além de depender da natureza da substância, este valor numérico depende de cada mudança de estado físico. Por exemplo, para a água:
- Calor latente de fusão: 80cal/g
- Calor latente de vaporização: 540cal/g
- Calor latente de solidificação: -80cal/g
- Calor latente de condensação: -540cal/g
- Capacidade Térmica:
É a quantidade de calor que um corpo necessita receber ou ceder para que sua temperatura varie uma unidade. Então, pode-se expressar esta relação como mostra a figura abaixo:
Sua unidade usual é cal/°C.
A capacidade térmica de 1g de água é de 1cal/°C já que seu calor específico é 1cal/g.°C.