A Estrutura Atômica da Matéria:
Desde a antiguidade o ser humano vem investigando para saber mais sobre a matéria e usar esse conhecimento para viver melhor. Uma curiosidade muita antiga é esta:
Tudo o que existe é feito de matéria, mas de que é feita a matéria?
Pelos registros que temos até hoje, as respostas mais antigas obtidas pela humanidade para as questões colocadas na página anterior tiveram por base a religião e a mitologia.
No entanto, essas explicações não atendiam às necessidades práticas das sociedades da época. Não forneciam, por exemplo, o conhecimento que se fazia necessário à metalurgia e, mais tarde, à siderurgia.
Há milhares de anos, o ser humano é capaz de misturar alguns materiais e, com isso, obter outros materiais, diferentes dos animais. Um exemplo é a liga de bronze – mistura dos metais cobre e estanho, que já era produzida há 5000 anos.
Com esses avanços, outras questões surgiram:
Os escritos mais antigos que contêm explicações sobre a estrutura da matéria pertencem aos filósofos gregos do século V antes de Cristo.
Há cerca de 2500 anos, os filósofos gregos Leucipo e Demócrito indagavam sobre a estrutura fundamental da matéria. Eles afirmaram que a água, então tida como um elemento fundamental de tudo o que existe, era composta por partículas indivisíveis que receberam o nome de átomos. A palavra átomo significa, em grego, “indivisível”.
Todo e qualquer tipo de matéria existente no Universo seria constituído de átomos. Os diversos materiais teriam em sua constituição átomos diferentes, e esses átomos estariam em diferentes proporções.
Essa ideia de átomo – partícula indivisível da matéria – foi aceita sem alterações significativas por mais de 2 000 anos.
Tudo o que existe é feito de matéria, mas de que é feita a matéria?
Pelos registros que temos até hoje, as respostas mais antigas obtidas pela humanidade para as questões colocadas na página anterior tiveram por base a religião e a mitologia.
No entanto, essas explicações não atendiam às necessidades práticas das sociedades da época. Não forneciam, por exemplo, o conhecimento que se fazia necessário à metalurgia e, mais tarde, à siderurgia.
Há milhares de anos, o ser humano é capaz de misturar alguns materiais e, com isso, obter outros materiais, diferentes dos animais. Um exemplo é a liga de bronze – mistura dos metais cobre e estanho, que já era produzida há 5000 anos.
Com esses avanços, outras questões surgiram:
- Porque alguns tipos de material, ao se misturarem se transforma em outro material?
- Como ocorrem essas transformações?
Os escritos mais antigos que contêm explicações sobre a estrutura da matéria pertencem aos filósofos gregos do século V antes de Cristo.
Há cerca de 2500 anos, os filósofos gregos Leucipo e Demócrito indagavam sobre a estrutura fundamental da matéria. Eles afirmaram que a água, então tida como um elemento fundamental de tudo o que existe, era composta por partículas indivisíveis que receberam o nome de átomos. A palavra átomo significa, em grego, “indivisível”.
Todo e qualquer tipo de matéria existente no Universo seria constituído de átomos. Os diversos materiais teriam em sua constituição átomos diferentes, e esses átomos estariam em diferentes proporções.
Essa ideia de átomo – partícula indivisível da matéria – foi aceita sem alterações significativas por mais de 2 000 anos.
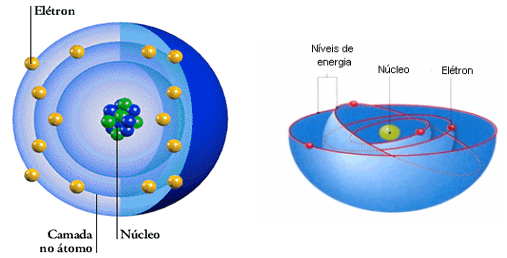
O Interior do Átomo:
No centro de um átomo está o seu núcleo, que apesar de pequeno, contém quase toda a massa do átomo. Os prótons e os nêutrons são as partículas nele encontradas, cada um com uma massa atômica unitária.
O Número de prótons no núcleo estabelece o número atômico do elemento químico e, o número de prótons somado ao número de nêutrons é o número de massa atômica. Os elétrons ficam fora do núcleo e tem pequena massa.
Características das Partículas:
- Cargas elétricas e massas:
Inúmeros experimentos realizados permitiram estabelecer as propriedades das partículas do átomo quanto à sua carga elétrica e massa.
Quando à carga elétrica: considera-se a carga do próton igual a +1; a carga do elétron igual a -1, e a carga do nêutron igual a 0.
Como se sabe, cargas elétricas de mesma intensidade e de sinais contrários se neutralizam. Ou seja, a carga elétrica de um próton (positiva) anula a carga elétrica de um elétron (negativa). Qualquer átomo apresenta número de prótons e de elétrons iguais; logo, é eletricamente neutro.
Quanto a massa: tendo o valor da massa do próton como referência, afirma-se que a massa do nêutron é praticamente igual à massa do próton. Como o próton possui massa cerca de 2 mil vezes maior que a de um elétron, esta última é considerada desprezível.
- O núcleo do átomo:
Agora, vamos considerar melhor as características do núcleo atômico.
Após estudos definiu-se que o número de prótons é uma das principais características que diferenciam um átomo do outro.
Esse número é chamado de número atômico e é representado pela letra Z.
Z é a “carteira de identidade” do átomo, pois indica a qual elemento químico cada átomo pertence.
O conjunto dos átomos que possuem o mesmo número atômico (Z) é denominado elemento químico.
Portanto, a partir do conceito de elemento químico, á possível afirmar que átomos com número de prótons diferentes entre si pertencem, obrigatoriamente a elementos químicos diferentes. Vejamos:
O átomo de sódio tem 11 prótons; logo, seu número atômico é igual a 11 (Z = 11), e todos os átomos com número atômico (Z) igual a 11 pertencem ao elemento químico sódio.
Nesta expressão, temos: A = número de massa;
p = número de prótons;
n = número de nêutrons.
Logo, a diferença entre o número de massa e o número atômico revela o número de nêutrons.
A soma do número de prótons com o número de nêutrons, ou seja, o número de massa (A), não corresponde a toda a massa do átomo, pois também existem os elétrons. O motivo de A representar a massa do átomo é que a amassa do elétron é desprezível quando comparada com a dos prótons e nêutrons.
Átomos pertencentes ao mesmo elemento químico podem apresentar diferentes números de nêutrons. A prata, por exemplo, é encontrada na natureza com números de nêutrons distintos: 60 e 62. Se somarmos esses números com o número de prótons, que é igual a 47, teremos:
60 nêutrons + 47 prótons = 107 como número de massa.
62 nêutrons + 47 prótons = 109 como número de massa.
Por isso, somente o número atômico pode identificar a que elemento químico o átomo pertence.
O Número de prótons no núcleo estabelece o número atômico do elemento químico e, o número de prótons somado ao número de nêutrons é o número de massa atômica. Os elétrons ficam fora do núcleo e tem pequena massa.
Características das Partículas:
- Prótons: tem carga elétrica positiva e uma massa unitária.
- Nêutrons: não tem carga elétrica, mas tem massa unitária.
- Elétrons: tem carga elétrica negativa e quase não possuem massa.
- Cargas elétricas e massas:
Inúmeros experimentos realizados permitiram estabelecer as propriedades das partículas do átomo quanto à sua carga elétrica e massa.
Quando à carga elétrica: considera-se a carga do próton igual a +1; a carga do elétron igual a -1, e a carga do nêutron igual a 0.
Como se sabe, cargas elétricas de mesma intensidade e de sinais contrários se neutralizam. Ou seja, a carga elétrica de um próton (positiva) anula a carga elétrica de um elétron (negativa). Qualquer átomo apresenta número de prótons e de elétrons iguais; logo, é eletricamente neutro.
Quanto a massa: tendo o valor da massa do próton como referência, afirma-se que a massa do nêutron é praticamente igual à massa do próton. Como o próton possui massa cerca de 2 mil vezes maior que a de um elétron, esta última é considerada desprezível.
- O núcleo do átomo:
Agora, vamos considerar melhor as características do núcleo atômico.
- Número atômico:
Após estudos definiu-se que o número de prótons é uma das principais características que diferenciam um átomo do outro.
Esse número é chamado de número atômico e é representado pela letra Z.
Z é a “carteira de identidade” do átomo, pois indica a qual elemento químico cada átomo pertence.
O conjunto dos átomos que possuem o mesmo número atômico (Z) é denominado elemento químico.
Portanto, a partir do conceito de elemento químico, á possível afirmar que átomos com número de prótons diferentes entre si pertencem, obrigatoriamente a elementos químicos diferentes. Vejamos:
O átomo de sódio tem 11 prótons; logo, seu número atômico é igual a 11 (Z = 11), e todos os átomos com número atômico (Z) igual a 11 pertencem ao elemento químico sódio.
- Número de massa:
Nesta expressão, temos: A = número de massa;
p = número de prótons;
n = número de nêutrons.
Logo, a diferença entre o número de massa e o número atômico revela o número de nêutrons.
A soma do número de prótons com o número de nêutrons, ou seja, o número de massa (A), não corresponde a toda a massa do átomo, pois também existem os elétrons. O motivo de A representar a massa do átomo é que a amassa do elétron é desprezível quando comparada com a dos prótons e nêutrons.
Átomos pertencentes ao mesmo elemento químico podem apresentar diferentes números de nêutrons. A prata, por exemplo, é encontrada na natureza com números de nêutrons distintos: 60 e 62. Se somarmos esses números com o número de prótons, que é igual a 47, teremos:
60 nêutrons + 47 prótons = 107 como número de massa.
62 nêutrons + 47 prótons = 109 como número de massa.
Por isso, somente o número atômico pode identificar a que elemento químico o átomo pertence.
Íon:
O átomo que possui p = é, ou seja, o número de prótons igual ao número de elétrons é eletricamente neutro.
Íon positivo (+) doa elétrons – íon cátion. Ex. Na+
Íon negativo (-) recebe elétrons – íon ânion. Ex. Cl-
Quando um cátion doa elétrons, ele fica positivo.
Quando um ânion ganha elétrons, ele fica negativo.
- Átomo neutro = p = é
- Íon = p ≠ é
Íon positivo (+) doa elétrons – íon cátion. Ex. Na+
Íon negativo (-) recebe elétrons – íon ânion. Ex. Cl-
Quando um cátion doa elétrons, ele fica positivo.
Quando um ânion ganha elétrons, ele fica negativo.
Isótopo, Isóbaro e Isótono:
Se observarmos o número atômico, número de massa e de nêutrons de diferentes átomos podemos encontrar conjuntos de átomos com outro número igual.
Os isótopos são átomos que possuem o mesmo número de prótons (p) e diferente número de massa (A).
Exemplo: o hidrogênio (H)
¹H ²H ³H
¹ ¹ ¹
hidrogênio deutério trítio
Z = 1 Z = 1 Z = 1
A = 1 A = 2 A = 3
Este fenômeno é muito comum na natureza. Quase todos os elementos químicos naturais são formados por mistura de isótopos.
Os isóbaros são átomos que possuem o mesmo número de massa (A) e diferente número de prótons.
Exemplo:
40K 40Ca
19 20
A = 40 A = 40
Z = 19 Z = 20
São átomos de elementos químicos diferentes, mas que tem o mesmo número de massa.
Os isótonos são átomos que possuem o mesmo número de nêutrons e com diferentes números de prótons e de massa. São átomos de diferentes elementos químicos.
Exemplo:
A = 37Cl A = 40Ca
Z = 17 Z = 20
__________ __________
n = 20 n = 20
Os isótonos têm propriedades químicas e físicas diferentes.
Os isótopos são átomos que possuem o mesmo número de prótons (p) e diferente número de massa (A).
Exemplo: o hidrogênio (H)
¹H ²H ³H
¹ ¹ ¹
hidrogênio deutério trítio
Z = 1 Z = 1 Z = 1
A = 1 A = 2 A = 3
Este fenômeno é muito comum na natureza. Quase todos os elementos químicos naturais são formados por mistura de isótopos.
Os isóbaros são átomos que possuem o mesmo número de massa (A) e diferente número de prótons.
Exemplo:
40K 40Ca
19 20
A = 40 A = 40
Z = 19 Z = 20
São átomos de elementos químicos diferentes, mas que tem o mesmo número de massa.
Os isótonos são átomos que possuem o mesmo número de nêutrons e com diferentes números de prótons e de massa. São átomos de diferentes elementos químicos.
Exemplo:
A = 37Cl A = 40Ca
Z = 17 Z = 20
__________ __________
n = 20 n = 20
Os isótonos têm propriedades químicas e físicas diferentes.
Modelos Atômicos:
Sabemos que toda as variedades de matéria são feitas de pequenas partículas chamadas átomos. Foram os filósofos gregos que lançaram a concepção de átomo como constituinte da matéria.
No entanto, foi o inglês John Dalton que, em 1808, deu um caráter cientifico á ideia de átomo., De um modo geral, a teoria atômica clássica proposta por Dalton dizia que:
No entanto, foi o inglês John Dalton que, em 1808, deu um caráter cientifico á ideia de átomo., De um modo geral, a teoria atômica clássica proposta por Dalton dizia que:
- a matéria é formada por partículas extremamente pequenas chamadas átomos;
- os átomos são indivisíveis e indestrutíveis;
- os átomos de um mesmo elemento são iguais, enquanto os átomos de elementos diferentes também serão diferentes;
- na formação dos compostos químicos, os átomos se unem em proporções simples e definidas;
- as transformações químicas consistem em combinações, separações ou rearranjos de átomos.
Em 1897, Thomson propôs um modelo para o átomo como uma esfera carregada positivamente, na qual os elétrons estariam incrustados na sua superfície. As cargas positivas e negativas existiam em iguais quantidades, garantindo a neutralidade do átomo. O modelo ficou conhecido como "pudim de passas".
No início do século XX, vários experimentos levaram Ernest Rutherford, físico neozelandês, a concluir que o átomo apresenta duas regiões distintas. Lembrando as conclusões de 1911:
Outros modelos que vieram depois especificam as características das órbitas ou camadas de energia, incorporando a discussão de elétron considerado como partícula e/ou onda.
Pesquisas mais recentes, realizadas após a elaboração do modelo de Rutherford-Böhr, comprovaram que impossível determinar num mesmo instante a posição e a velocidade de um elétron. Por isso, cientistas afirmam que existe a probabilidade de os elétrons estarem em uma ou outra região da eletrosfera.
- núcleo: região central que concentra praticamente toda a massa do átomo. Contém os prótons (positivos) e nêutrons (carga elétrica nula);
- eletrosfera: envolve o núcleo e contém os elétrons (negativos).
- “O elétrons descreve uma órbita circular ao redor do núcleo sem ganhar ou perder energia.”
Outros modelos que vieram depois especificam as características das órbitas ou camadas de energia, incorporando a discussão de elétron considerado como partícula e/ou onda.
Pesquisas mais recentes, realizadas após a elaboração do modelo de Rutherford-Böhr, comprovaram que impossível determinar num mesmo instante a posição e a velocidade de um elétron. Por isso, cientistas afirmam que existe a probabilidade de os elétrons estarem em uma ou outra região da eletrosfera.