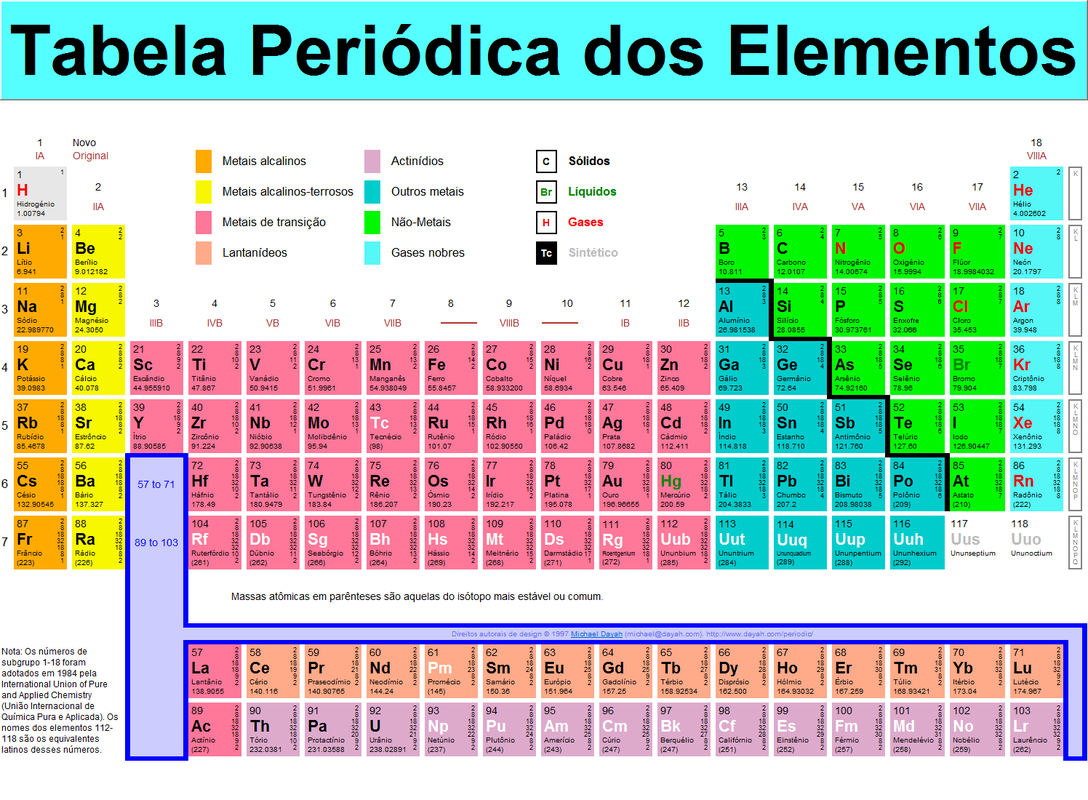
Tabela Periódica:
A partir do século XIX, cientistas começaram a perceber que os elementos químicos poderiam ser agrupados em colunas, formadas pela reunião de elementos com propriedades semelhantes.
O número de elementos químicos conhecidos pelo homem aumentou com o passar dos séculos, principalmente no XIX.
Observe a tabela:
ATÉ O FINAL DO SÉCULO Nº DE ELEMENTOS QUÍMICOS
XVI 14
XVII 33
XIX 83
XX 112
Alguns elementos que já eram conhecidos antes de 1650, como Ag, C, As, Au, Hg, Pb, Sn, Sb, Cu, S.
Depois de tantos químicos tentarem classificar os elementos químicos, Dmitri Ivanovitch Mendeleev foi o que mais se destacou. Seu trabalho em classificar os elementos é usado até hoje. Ele criou uma tabela periódica dos elementos, que serviu de base para organizar a que temos hoje.
Mendeleev observou que há uma periodicidade das propriedades quando os elementos químicos eram colocados em ordem crescente de suas massas atômicas.
O número de elementos químicos conhecidos pelo homem aumentou com o passar dos séculos, principalmente no XIX.
Observe a tabela:
ATÉ O FINAL DO SÉCULO Nº DE ELEMENTOS QUÍMICOS
XVI 14
XVII 33
XIX 83
XX 112
Alguns elementos que já eram conhecidos antes de 1650, como Ag, C, As, Au, Hg, Pb, Sn, Sb, Cu, S.
Depois de tantos químicos tentarem classificar os elementos químicos, Dmitri Ivanovitch Mendeleev foi o que mais se destacou. Seu trabalho em classificar os elementos é usado até hoje. Ele criou uma tabela periódica dos elementos, que serviu de base para organizar a que temos hoje.
Mendeleev observou que há uma periodicidade das propriedades quando os elementos químicos eram colocados em ordem crescente de suas massas atômicas.
- Lei da periodicidade – muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.
Como usar a Tabela Periódica:
Cada quadro da tabela fornece os dados referentes ao elemento químico: símbolo, massa atômica, número atômico, nome do elemento, elétrons nas camadas e se o elemento é radioativo.
As filas horizontais são denominadas períodos. Neles os elementos químicos estão dispostos na ordem crescente de seus números atômicos. O número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento.
A tabela periódica apresenta sete períodos:
1º período – 2 elementos
2º período – 8 elementos
3º período – 8 elementos
4º período – 18 elementos
5º período – 18 elementos
6º período – 32 elementos
7º período – até agora 30 elementos
As colunas verticais constituem as famílias ou grupos, nas quais os elementos estão reunidos segundo suas propriedades químicas.
As famílias ou grupos vão de 1 a 18. Algumas famílias possuem nome, como por exemplo:
1 ou 1A – alcalinos
2 ou 2A– alcalinos terrosos
13 ou 3A– família do boro
14 ou 4A– família do carbono
15 ou 5A– família do nitrogênio
16 ou 6A– família dos calcogênios
17 ou 7A– família dos halogênios
18 ou 8A– gases nobres
Da família 1 e 2 e 13 até 18 chamamos de elementos representativos.
Da família do 3 até 12 chamamos de elementos de transição.
Os elementos que ficam na série dos lantanídeos e actinídeos são os elementos de transição. Como eles estão no grupo 3, como se estivessem numa “caixinha” para dentro da tabela, são chamados de elementos de transição interna. E os demais são chamados de elementos de transição externa.
As filas horizontais são denominadas períodos. Neles os elementos químicos estão dispostos na ordem crescente de seus números atômicos. O número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento.
A tabela periódica apresenta sete períodos:
1º período – 2 elementos
2º período – 8 elementos
3º período – 8 elementos
4º período – 18 elementos
5º período – 18 elementos
6º período – 32 elementos
7º período – até agora 30 elementos
As colunas verticais constituem as famílias ou grupos, nas quais os elementos estão reunidos segundo suas propriedades químicas.
As famílias ou grupos vão de 1 a 18. Algumas famílias possuem nome, como por exemplo:
1 ou 1A – alcalinos
2 ou 2A– alcalinos terrosos
13 ou 3A– família do boro
14 ou 4A– família do carbono
15 ou 5A– família do nitrogênio
16 ou 6A– família dos calcogênios
17 ou 7A– família dos halogênios
18 ou 8A– gases nobres
Da família 1 e 2 e 13 até 18 chamamos de elementos representativos.
Da família do 3 até 12 chamamos de elementos de transição.
Os elementos que ficam na série dos lantanídeos e actinídeos são os elementos de transição. Como eles estão no grupo 3, como se estivessem numa “caixinha” para dentro da tabela, são chamados de elementos de transição interna. E os demais são chamados de elementos de transição externa.
Metais, não-metais, semimetais e gases nobres:

Os elementos químicos estão reunidos em quatro grandes grupos: metais, não-metais, semimetais e gases nobres. O hidrogênio (H) não se encaixa em nenhuma dessas classificações porque possui características próprias. Algumas tabelas mostram esta divisão.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Quase todos os metais têm brilho, pois são capazes de refletir muito bem a luz. Ouro, prata e alumínio são exemplos de metais com muito brilho.
Os metais são bons condutores elétricos. Como em geral apresentam ductibilidade, ou seja, podem ser reduzidos a fios, são usados como tal na condução de eletricidade.
Os metais conduzem bem o calor. Nem sempre um metal puro apresenta as propriedades desejáveis para determinadas aplicações. Por isso são produzidas as ligas metálicas, onde dois ou mais metais são misturados. São exemplos o bronze e o latão. O bronze é uma mistura de cobre, estanho e o latão é resultado da mistura de cobre e zinco.
A maioria das ligas é formada por dois ou mais metais, mas algumas contêm não-metais, como o carbono. A liga mais usada desse tipo é o aço.
Os não-metais são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis e nem dúcteis. Tendem a formar ânions (íons negativos).
Os semimetais apresentam propriedades “intermediárias” entre a dos metais e a dos não-metais. Eles formam substâncias simples sólidas nas condições ambientes. Dois semimetais de muita importância prática são o silício e o germânio, empregados em componentes eletrônicos.
Os gases nobres ou inertes, ou ainda raros, constituem cerca de 1% do ar. É muito difícil se conseguir compostos com estes gases. Raramente eles reagem porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons. Estão todos no grupo 18 da tabela periódica.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Quase todos os metais têm brilho, pois são capazes de refletir muito bem a luz. Ouro, prata e alumínio são exemplos de metais com muito brilho.
Os metais são bons condutores elétricos. Como em geral apresentam ductibilidade, ou seja, podem ser reduzidos a fios, são usados como tal na condução de eletricidade.
Os metais conduzem bem o calor. Nem sempre um metal puro apresenta as propriedades desejáveis para determinadas aplicações. Por isso são produzidas as ligas metálicas, onde dois ou mais metais são misturados. São exemplos o bronze e o latão. O bronze é uma mistura de cobre, estanho e o latão é resultado da mistura de cobre e zinco.
A maioria das ligas é formada por dois ou mais metais, mas algumas contêm não-metais, como o carbono. A liga mais usada desse tipo é o aço.
Os não-metais são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis e nem dúcteis. Tendem a formar ânions (íons negativos).
Os semimetais apresentam propriedades “intermediárias” entre a dos metais e a dos não-metais. Eles formam substâncias simples sólidas nas condições ambientes. Dois semimetais de muita importância prática são o silício e o germânio, empregados em componentes eletrônicos.
Os gases nobres ou inertes, ou ainda raros, constituem cerca de 1% do ar. É muito difícil se conseguir compostos com estes gases. Raramente eles reagem porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons. Estão todos no grupo 18 da tabela periódica.