Matéria:
Matéria é tudo o que tem massa e ocupa espaço.
Qualquer coisa que tenha existência física ou real é matéria. Tudo o que existe no universo conhecido manifesta-se como matéria ou energia.
A matéria pode ser líquida, sólida ou gasosa. São exemplos de matéria: papel, madeira, ar, água, pedra.
- Substância e Mistura:
Analisando a matéria qualitativamente (qualidade) chamamos a matéria de substância.
Exemplos de substância simples: ouro, mercúrio, ferro, zinco.
Exemplos de substância composta: água, açúcar (sacarose), sal de cozinha (cloreto de sódio).
- Corpo e Objeto:
Analisando a matéria quantitativamente chamamos a matéria de Corpo.
Corpo - São quantidades limitadas de matéria. Como por exemplo: um bloco de gelo, uma barra de ouro.
Os corpos trabalhados e com certo uso são chamados de objetos. Uma barra de ouro (corpo) pode ser transformada em anel, brinco (objeto).
- Fênomenos Químicos e Físicos:
Fenômeno é uma transformação da matéria. Pode ser química ou física.
Fenômeno Químico é uma transformação da matéria com alteração da sua composição.
Exemplos: combustão de um gás, da madeira, formação da ferrugem, eletrólise da água.
Química – é a ciência que estuda os fenômenos químicos. Estuda as diferentes substâncias, suas transformações e como elas interagem e a energia envolvida.
Fenômenos Físicos - é a transformação da matéria sem alteração da sua composição.
Exemplos: reflexão da luz, solidificação da água, ebulição do álcool etílico.
Física – é a ciência que estuda os fenômenos físicos. Estuda as propriedades da matéria e da energia, sem que haja alteração química.
Qualquer coisa que tenha existência física ou real é matéria. Tudo o que existe no universo conhecido manifesta-se como matéria ou energia.
A matéria pode ser líquida, sólida ou gasosa. São exemplos de matéria: papel, madeira, ar, água, pedra.
- Substância e Mistura:
Analisando a matéria qualitativamente (qualidade) chamamos a matéria de substância.
- Substância – possui uma composição característica, determinada e um conjunto definido de propriedades.
Exemplos de substância simples: ouro, mercúrio, ferro, zinco.
Exemplos de substância composta: água, açúcar (sacarose), sal de cozinha (cloreto de sódio).
- Mistura – são duas ou mais substâncias agrupadas, onde a composição é variável e suas propriedades também.
- Corpo e Objeto:
Analisando a matéria quantitativamente chamamos a matéria de Corpo.
Corpo - São quantidades limitadas de matéria. Como por exemplo: um bloco de gelo, uma barra de ouro.
Os corpos trabalhados e com certo uso são chamados de objetos. Uma barra de ouro (corpo) pode ser transformada em anel, brinco (objeto).
- Fênomenos Químicos e Físicos:
Fenômeno é uma transformação da matéria. Pode ser química ou física.
Fenômeno Químico é uma transformação da matéria com alteração da sua composição.
Exemplos: combustão de um gás, da madeira, formação da ferrugem, eletrólise da água.
Química – é a ciência que estuda os fenômenos químicos. Estuda as diferentes substâncias, suas transformações e como elas interagem e a energia envolvida.
Fenômenos Físicos - é a transformação da matéria sem alteração da sua composição.
Exemplos: reflexão da luz, solidificação da água, ebulição do álcool etílico.
Física – é a ciência que estuda os fenômenos físicos. Estuda as propriedades da matéria e da energia, sem que haja alteração química.
Propriedades da Matéria:
O que define a matéria são suas propriedades.
Existem as propriedades gerais e as propriedades específicas.
As propriedades gerais são comuns para todo tipo de matéria e não permitem diferenciar uma da outra. São elas: massa, peso, inércia, elasticidade, compressibilidade, extensão, divisibilidade, impenetrabilidade.
As propriedades organolépticas podem ser percebidas pelos órgãos dos sentidos (olhos, nariz, língua). São elas: cor, brilho, odor e sabor.
As propriedades físicas são: ponto de fusão e ponto de ebulição, solidificação, liquefação, calor específico, densidade absoluta, propriedades magnéticas, maleabilidade, ductibilidade, dureza e tenacidade.
Existem as propriedades gerais e as propriedades específicas.
As propriedades gerais são comuns para todo tipo de matéria e não permitem diferenciar uma da outra. São elas: massa, peso, inércia, elasticidade, compressibilidade, extensão, divisibilidade, impenetrabilidade.
- Massa – medida da quantidade de matéria de um corpo. Determina a inércia e o peso.
- Inércia – resistência que um corpo oferece a qualquer tentativa de variação do seu estado de movimento ou de repouso. O corpo que está em repouso, tende a ficar em repouso e o que está em movimento tende a ficar em movimento, com velocidade e direção constantes.
- Peso – é a força gravitacional entre o corpo e a Terra.
- Elasticidade – propriedade onde a matéria tem de retornar ao seu volume inicial após cessar a força que causa a compressão.
- Compressibilidade – propriedade onde a matéria tem de reduzir seu volume quando submetida a certas pressões.
- Extensão – propriedade onde a matéria tem de ocupar lugar no espaço.
- Divisibilidade – a matéria pode ser dividida em porções cada vez menores. A menor porção da matéria é a molécula, que ainda conserva as suas propriedades.
- Impenetrabilidade – dois corpos não podem ocupar o mesmo espaço ao mesmo tempo.
As propriedades organolépticas podem ser percebidas pelos órgãos dos sentidos (olhos, nariz, língua). São elas: cor, brilho, odor e sabor.
As propriedades físicas são: ponto de fusão e ponto de ebulição, solidificação, liquefação, calor específico, densidade absoluta, propriedades magnéticas, maleabilidade, ductibilidade, dureza e tenacidade.
- Ponto de fusão e solidificação – são as temperaturas onde a matéria passa da fase sólida para a fase líquida e da fase líquida para a fase sólida, respectivamente.
- Ponto de ebulição e de liquefação – são as temperaturas onde a matéria passa da fase líquida para a fase gasosa e da fase gasosa para a líquida, respectivamente.
- Calor específico – é a quantidade de calor necessária para aumentar em 1 grau Celsius (°C) a temperatura de 1grama de massa de qualquer substância. Pode ser medida em calorias.
- Densidade absoluta – relação entre massa e volume de um corpo.
- Propriedade magnética – capacidade que uma substância tem de atrair pedaços de ferro (Fe) e níquel (Ni).
- Maleabilidade – é a propriedade que permite à matéria ser transformada em lâmina. Característica dos metais.
- Ductibilidade – capacidade que a substância tem de ser transformada em fios. Característica dos metais.
- Dureza – é determinada pela resistência que a superfície do material oferece ao risco por outro material. O diamante é o material que apresenta maior grau de dureza na natureza.
- Tenacidade – é a resistência que os materiais oferecem ao choque mecânico, ou seja, ao impacto. Resiste ao forte impacto sem se quebrar.
Misturas:

- Misturas e substâncias:
Mistura – é formada por duas ou mais substâncias puras. As misturas têm composição química variável, não expressa por uma fórmula.
Algumas misturas são tão importantes que têm nome próprio. São exemplos:
- gasolina – mistura de hidrocarbonetos, que são substâncias formadas por hidrogênio e carbono.
- ar atmosférico – mistura de 78% de nitrogênio, 21% de oxigênio, 1% de argônio e mais outros gases, como o gás carbônico.
- álcool hidratado – mistura de 96% de álcool etílico mais 4% de água.
Substância – é cada uma das espécies de matéria que constitui o universo. Pode ser simples ou composta.
- Sistemas e fases:
Sistema – é uma parte do universo que se deseja observar, analisar. Por exemplo: um tubo de ensaio com água, um pedaço de ferro, uma mistura de água e gasolina, etc.
Fases – é o aspecto visual uniforme.
As misturas podem conter uma ou mais fases.
- água + sal
- água + álcool etílico
- água + acetona
- água + açúcar
- água + sais minerais
- água + óleo
- granito
- água + enxofre
- água + areia + óleo
Os sistemas monofásicos são as misturas homogêneas.
Os sistemas polifásicos são as misturas heterogêneas.
Os sistemas homogêneos, quando formados por duas ou mais substâncias miscíveis (que se misturam) umas nas outras chamamos de soluções.
São exemplos de soluções: água salgada, vinagre, álcool hidratado.
Os sistemas heterogêneos podem ser formados por uma única substância, porém em várias fases de agregação (estados físicos).
Exemplo: água
- líquida
- sólida (gelo)
- vapor
Mistura – é formada por duas ou mais substâncias puras. As misturas têm composição química variável, não expressa por uma fórmula.
Algumas misturas são tão importantes que têm nome próprio. São exemplos:
- gasolina – mistura de hidrocarbonetos, que são substâncias formadas por hidrogênio e carbono.
- ar atmosférico – mistura de 78% de nitrogênio, 21% de oxigênio, 1% de argônio e mais outros gases, como o gás carbônico.
- álcool hidratado – mistura de 96% de álcool etílico mais 4% de água.
Substância – é cada uma das espécies de matéria que constitui o universo. Pode ser simples ou composta.
- Sistemas e fases:
Sistema – é uma parte do universo que se deseja observar, analisar. Por exemplo: um tubo de ensaio com água, um pedaço de ferro, uma mistura de água e gasolina, etc.
Fases – é o aspecto visual uniforme.
As misturas podem conter uma ou mais fases.
- Mistura Homogênea – é formada por apenas uma fase. Não se consegue diferencias a substância.
- água + sal
- água + álcool etílico
- água + acetona
- água + açúcar
- água + sais minerais
- Mistura Heterogênea – é formada por duas ou mais fases. As substâncias podem ser diferenciadas a olho nu ou pelo microscópio.
- água + óleo
- granito
- água + enxofre
- água + areia + óleo
Os sistemas monofásicos são as misturas homogêneas.
Os sistemas polifásicos são as misturas heterogêneas.
Os sistemas homogêneos, quando formados por duas ou mais substâncias miscíveis (que se misturam) umas nas outras chamamos de soluções.
São exemplos de soluções: água salgada, vinagre, álcool hidratado.
Os sistemas heterogêneos podem ser formados por uma única substância, porém em várias fases de agregação (estados físicos).
Exemplo: água
- líquida
- sólida (gelo)
- vapor
Estados físicos da matéria:
Uma substância pode ser encontrada no estado físico líquido, sólido ou gasoso. Estes diferentes aspectos são chamados de fases de agregação e dependem da temperatura e pressão.
Existem ainda um quarto estado, chamado de plasma, que somente ocorre em condições altíssimas de temperatura, como no núclo do Sol. Lá, os átomos de hélio ficam a uma temperatura e pressão muito altas, fazendo com que os seus elétrons sejam desprendidos de seus átomos.
- Mudanças de fases:
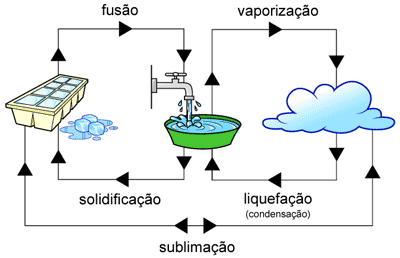
No nosso dia-a-dia observamos que o gelo se derrete sob a ação do calor transformando-se em água. A água ferve sob calor mais intenso transformando-se em vapor d água. A água, neste caso, apresenta três estados: sólido, líquido e gasoso. São também chamado de estados físicos ou estado de agregação da matéria. Quando se transformam de um estado para o outro chamamos de Mudança de Estados Físicos. Cada transformação recebe um nome:
Fusão – mudança do estado sólido para o líquido.
Vaporização ou Ebulição – mudança do estado líquido para o gasoso.
Liquefação ou Condensação – mudança do estado gasoso para o líquido.
Solidificação – mudança do estado líquido para o sólido.
Sublimação – mudança do estado sólido para o gasoso e vice-versa (ressublimação).
- Sólido: É quando os átomos das moléculas constituintes da matéria estão em um estado de agitação baixo, podendo ser concentrados mais átomos em um mesmo espaço físico. A sua forma e volume são fixos. Por exemplo, uma bola de boliche. Pode ser colocada em qualquer tipo de recipiente que ela não tomará a forma do recipiente, e o seu volume não vai aumentar ou diminuir.
- Líquido: Ocorre quando as moléculas já estão um pouco mais dispersos, em relação à mesma matéria no estado sólido. Substâncias no estado líquido tem volume fixo, porém a sua forma pode variar. Por exemplo, a água. Se estiver em um copo, toma a forma do copo, se estiver na jarra, fica na forma da jarra.
- Gasoso: Acontece quando as partículas que formam a matéria estão bastante afastadas, dispersas no espaço. Por isto elas podem ter a forma e o volume variável. Exemplo, ar atmosférico. O ar de uma sala inteira pode ser comprimido dentro de um cilindro, e tomando a forma do mesmo.
Existem ainda um quarto estado, chamado de plasma, que somente ocorre em condições altíssimas de temperatura, como no núclo do Sol. Lá, os átomos de hélio ficam a uma temperatura e pressão muito altas, fazendo com que os seus elétrons sejam desprendidos de seus átomos.
- Mudanças de fases:
No nosso dia-a-dia observamos que o gelo se derrete sob a ação do calor transformando-se em água. A água ferve sob calor mais intenso transformando-se em vapor d água. A água, neste caso, apresenta três estados: sólido, líquido e gasoso. São também chamado de estados físicos ou estado de agregação da matéria. Quando se transformam de um estado para o outro chamamos de Mudança de Estados Físicos. Cada transformação recebe um nome:
Fusão – mudança do estado sólido para o líquido.
Vaporização ou Ebulição – mudança do estado líquido para o gasoso.
Liquefação ou Condensação – mudança do estado gasoso para o líquido.
Solidificação – mudança do estado líquido para o sólido.
Sublimação – mudança do estado sólido para o gasoso e vice-versa (ressublimação).
Alotropia:

Diamante e sua estrutura
Alotropia é a propriedade que alguns elementos químicos têm de formar uma ou mais substâncias simples diferentes.
São alótropos: carbono, oxigênio, fósforo e enxofre.
O carbono possui dois alótropos: o diamante e o grafite.
Essas duas substâncias parecem não ter nada em comum. O grafite é um sólido macio e cinzento, com fraco brilho metálico, conduz bem a eletricidade e calor e tem densidade 2,25g/mL. O diamante é sólido duro (o mais duro de todos), tem brilho adamantino, não conduz eletricidade nem calor e tem densidade 3,51g/mL. Mas as duas têm em comum a mesma composição química expressa pela fórmula Cn, sendo n um número muito grande e indeterminado.
A principal diferença está no arranjo cristalino dos átomos de carbono. No grafite formam-se hexágonos. Cada átomo de carbono é ligado a apenas três outros átomos de carbono, em lâminas planas, fracamente atraídas umas pelas outras. No diamante, cada átomo de carbono está ligado a quatro outros átomos também de carbono.
O oxigênio tem dois alótropos, formando duas substâncias simples: o gás oxigênio (O2) e o gás ozônio (O3).
O gás oxigênio é incolor e inodoro. Faz parte da atmosfera e é indispensável à vida dos seres aeróbicos. As plantas o devolvem para a atmosfera ao realizar a fotossíntese.
O gás ozônio é um gás azulado de cheiro forte e desagradável. Como agente bactericida, ele é usado na purificação da água nos chamados ozonizadores. O ozônio está presente na estratosfera, a mais ou menos 20Km a 30Km da superfície da terrestre. Ele forma uma camada que absorve parte dos raios ultravioletas (UV) do Sol, impedindo que eles se tornem prejudiciais aos organismos vivos.
São alótropos: carbono, oxigênio, fósforo e enxofre.
O carbono possui dois alótropos: o diamante e o grafite.
Essas duas substâncias parecem não ter nada em comum. O grafite é um sólido macio e cinzento, com fraco brilho metálico, conduz bem a eletricidade e calor e tem densidade 2,25g/mL. O diamante é sólido duro (o mais duro de todos), tem brilho adamantino, não conduz eletricidade nem calor e tem densidade 3,51g/mL. Mas as duas têm em comum a mesma composição química expressa pela fórmula Cn, sendo n um número muito grande e indeterminado.
A principal diferença está no arranjo cristalino dos átomos de carbono. No grafite formam-se hexágonos. Cada átomo de carbono é ligado a apenas três outros átomos de carbono, em lâminas planas, fracamente atraídas umas pelas outras. No diamante, cada átomo de carbono está ligado a quatro outros átomos também de carbono.
O oxigênio tem dois alótropos, formando duas substâncias simples: o gás oxigênio (O2) e o gás ozônio (O3).
O gás oxigênio é incolor e inodoro. Faz parte da atmosfera e é indispensável à vida dos seres aeróbicos. As plantas o devolvem para a atmosfera ao realizar a fotossíntese.
O gás ozônio é um gás azulado de cheiro forte e desagradável. Como agente bactericida, ele é usado na purificação da água nos chamados ozonizadores. O ozônio está presente na estratosfera, a mais ou menos 20Km a 30Km da superfície da terrestre. Ele forma uma camada que absorve parte dos raios ultravioletas (UV) do Sol, impedindo que eles se tornem prejudiciais aos organismos vivos.